Бретарис® Дженуэйр® (Bretaris Genuair) инструкция по применению
Владелец регистрационного удостоверения:
Лекарственная форма
|
|
Бретарис® Дженуэйр® |
Порошок для ингаляций дозированный 322 мкг/1 доза: ингаляторы 30 доз 1 шт. или 60 доз 1 или 3 шт.
рег. №: ЛП-003216
от 23.09.15
- Действующее
Дата переоформления: 24.09.20
|
Форма выпуска, упаковка и состав препарата Бретарис® Дженуэйр®
Порошок для ингаляций дозированный - содержимое картриджа: белый или почти белый, мелкодисперсный, легкосыпучий порошок, не содержащий видимых агломератов или посторонних частиц.
Пластиковый ингалятор белого цвета с зеленой защитной крышкой, с зеленой дозирующей клавишей и закрепленной сдвигающейся крышкой, с картриджем, содержащим препарат, и счетчиком на 30 или 60 доз.
| 1 доза* | |
| аклидиния бромид микронизированный | 0.4 мг |
* в одной дозе содержится 400 мкг аклидиния бромида, что эквивалентно 343 мкг аклидиния; это соответствует доставленной дозе 375 мкг аклидиния бромида, что эквивалентно 322 мкг аклидиния.
Вспомогательные вещества: α-лактозы моногидрат - 12.6 мг.
30 доз - ингаляторы пластиковые (1) - пакеты из фольги алюминиевой ламинированной (1) - пачки картонные с контролем первого вскрытия.
60 доз - ингаляторы пластиковые (1) - пакеты из фольги алюминиевой ламинированной (1) - пачки картонные с контролем первого вскрытия.
60 доз - ингаляторы пластиковые (1) - пакеты из фольги алюминиевой ламинированной (3) - пачки картонные с контролем первого вскрытия.
Фармакологическое действие
Аклидиния бромид является конкурентным, селективным антагонистом мускариновых рецепторов (также называемый антихолинергическим), с более длительным временем связывания с М3-рецепторами, чем с М2-рецепторами. М3-рецепторы служат посредниками при сокращении гладкой мускулатуры дыхательных путей. Вдыхаемый аклидиния бромид действует местно в легких, в качестве антагониста М3-рецепторов гладкой мускулатуры дыхательных путей и вызывает расширение бронхов. Доклинические исследования in vitro и in vivo продемонстрировали быстрое, дозозависимое и длительное ингибирование аклидиния бромидом бронхоспазма, вызванного ацетилхолином. Аклидиния бромид быстро разрушается в плазме, поэтому количество системных антихолинергических побочных действий является низким.
Фармакодинамическое действие
Исследования клинической эффективности показали, что препарат Бретарис® Дженуэйр® обеспечивает клинически значимое улучшение функции легких (оцениваемое по объему форсированного выдоха за одну секунду [ОФВ1]) в течение более чем 12 ч после утреннего и вечернего приема, которое проявлялось в течение 30 мин после приема первой дозы (прирост ОФВ1 по сравнению с исходным уровнем составляет 124-133 мл). Максимальная бронходилатация достигалась в течение 1-3 ч после приема дозы со средним пиком улучшений ОФВ1 по отношению к исходному уровню 227-268 мл в равновесном состоянии.
Электрофизиология сердца
При назначении аклидиния бромида (200 мкг или 800 мкг) здоровым добровольцам 1 раз/сут в течение 3 дней влияния на интервал QT (корригированное методом Фридериция или Базетта или индивидуально) не наблюдалось.
Также не было выявлено клинически значимого влияния препарата Бретарис® Дженуэйр® на сердечный ритм при проведении 24-часового Холтеровского мониторинга у 336 пациентов (164 из которых получали препарат Бретарис® Дженуэйр® 2 раза/сут в дозе 322 мкг) после 3 мес применения препарата.
Клиническая эффективность
Программа клинических исследований фазы III препарата Бретарис® Дженуэйр® включала 269 пациентов, получавших лечение препаратом Бретарис® Дженуэйр® в дозе 322 мкг 2 раза/сут в ходе одного 6-месячного рандомизированного исследования с контролем плацебо, и 190 пациентов, получавших лечение препаратом Бретарис® Дженуэйр® в дозе 322 мкг 2 раза/сут в ходе другого 3-мссячного рандомизированного исследования с контролем плацебо. Эффективность оценивалась по динамике функции легких и клинических симптомов, таких, как одышка, по обусловленному диагнозом статусу здоровья, применению препаратов экстренной терапии проведении долгосрочных исследований безопасности, препарат Бретарис® Дженуэйр® продемонстрировал бронходилатационную эффективность более 1 года.
Бронходилатация
При проведении 6-месячного исследования, у пациентов, получавших препарат Бретарис® Дженуэйр® в дозе 322 мкг 2 раза/сут, имело место клинически значимое улучшение функции легких (измеренное с помощью ОФВ1). Максимальное бронходилатационное действие проявлялось с первого дня и сохранялось в течение 6-месячного периода терапии применения. После 6 мес терапии, среднее улучшение перед приемом утренней дозы (минимум) ОФВ1 по сравнению с плацебо, составило 128 мл (95% ДИ=85-170; р< 0.0001).
Сходные наблюдения были сделаны для препарата Бретарис® Дженуэйр® во время проведения 3-месячного исследования.
Состояние здоровья, специфичное для заболевания и симптоматическое улучшение
Препарат Бретарис® Дженуэйр® обеспечивал клинически значимое улучшение в отношении одышки (оценивалось с помощью транзиторного индекса одышки [TDI]) и состояния здоровья, обусловленного заболеванием (оценивалось с помощью Респираторного опросника госпиталя Св. Георгия [SGRQ]). Нижеприведенная таблица показывает уменьшение симптомов после 6-месячного применения препарата Бретарис® Дженуэйр®.
| Переменная | Лечение | Улучшение по сравнению с плацебо | Значение Р | |
| Бретарис® Дженуэйр® | Плацебо | |||
| Транзиторный индекс одышки | ||||
| Процент пациентов с минимальным клинически важным различиема | 56.9 | 45.5 | 1.68-кратноес повышение вероятности | 0.004 |
| Среднее изменение по сравнению с исходным уровнем | 1.9 | 0.9 | 1.0 единица | < 0.001 |
| Респираторный опросник госпиталя Св. Георгия | ||||
| Процент пациентов с минимальным клинически важным различиемb | 57.3 | 41.0 | 1.87-кратноес повышение вероятности | < 0.001 |
| Среднее изменение по сравнению с исходным уровнем | -7.4 | -2.8 | -4.6 единицы | < 0.0001 |
а Минимальное клинически важное различие (MCID) по меньшей мере на 1 единицу изменения Транзиторного индекса одышки.
b Минимальное клинически важное различие (MCID) по меньшей мере на 4 единицы изменения по Респираторному опроснику госпиталя Св. Георгия.
с Отношение шансов, повышение вероятности достижения Минимального клинически важного различия по сравнению с плацебо.
Пациентам, получавшим препарат Бретарис® Дженуэйр®, требовалось меньше препаратов экстренной терапии, чем пациентам, получавшим плацебо (снижение на 0.95 введений в день за 6 мес [р=0.005]). Препарат Бретарис® Дженуэйр® также улучшал дневную симптоматику ХОБЛ (одышка, кашель и образование мокроты), а также ночные и ранние утренние клинические симптомы.
Пуловый анализ эффективности 6-месячных и 3-месячных исследований с контролем плацебо продемонстрировал значительное уменьшение частоты возникновения умеренных и тяжелых обострений (требующих терапии антибиотиками или ГКС или приводящих к госпитализации) при приеме 322 мкг аклидиния 2 раза/сут по сравнению с плацебо (частота на пациента в год: 0.31 против 0.44 соответственно; р=0.0149).
Толерантность к физической нагрузке
В ходе 3-недельного рандомизированного перекрестного клинического исследования с контролем плацебо на фоне применения препарата Бретарис® Дженуэйр® отмечалось статистически значимое увеличение продолжительности выполнения упражнений на 58 сек по сравнению с плацебо (95% ДИ=9-108; р=0.021; значения перед проведением терапии: 486 сек).
При применении препарата Бретарис® Дженуэйр® отмечалось статистически значимое снижение чрезмерного перерастяжения легких в покое (функциональная остаточная емкость [ФОЕ]=0.197 л [95% ДИ=0.321, 0.072; р=0.002]; остаточный объем [ПЖ]=0.238 л [95% ДИ=0.396, 0.079; р=0.004]), а также наблюдалось улучшение минимальной емкости вдоха (на 0.078 л; 95% ДИ=0.01, 0.145; р=0.025) и уменьшение одышки при выполнении упражнений (шкала Борга) (на 0.63 единиц Борга; 95% ДИ=1.11, 0.14; р=0.012).
Фармакокинетика
Аклидиния бромид быстро абсорбируется из легких, достигая Cmax в плазме крови в течение 5 мин после ингаляции у здоровых добровольцев, и обычно в течение первых 15 мин у пациентов с ХОВЛ. Фракция ингалированной дозы, достигшая системной циркуляции в качестве неизмененного аклидиния, является очень низкой, менее чем 5%.
Максимальная равновесная концентрация в плазме крови, достигнутая после ингаляции 400 мкг сухого порошка аклидиния бромида у пациентов с ХОБЛ, составила примерно 224 пг/мл. Равновесная концентрация в плазме крови была достигнута в течение 7 дней при приеме 2 раза/сут.
Распределение
Общее количество попадающего в легкие через ингалятор Бретарис® Дженуэйр® аклидиния бромида составило примерно 30% отмеренной дозы.
Связывание аклидиния бромида с белками плазмы in vitro, соответствует, скорее всего, связыванию метаболитов с белками, в связи с быстрым гидролизом аклидиния бромида в плазме, связывание с белками плазмы составило 87% для метаболита карбоновой кислоты и 15% для спиртового метаболита. Основным белком плазмы, который связывает аклидиния бромид, является альбумин.
Метаболизм
Аклидиния бромид быстро и активно гидролизуется до своих фармакологически неактивных спиртовых дериватов и дериватов карбоновой кислоты. Происходит как химический гидролиз (неферментативный), так и ферментативный, с участием эстераз. Основной эстеразой, вовлеченной в гидролиз у человека, является бутирилхолинэстераза. Уровень кислотного метаболита в плазме крови после ингаляции примерно в 100 раз выше, чем уровень спиртового метаболита и неизмененного действующего вещества.
Низкая абсолютная биодоступность аклидиния бромида при ингаляционном введении (<5%) связана с тем, что аклидиния бромид подвергается активному системному и пресистемному гидролизу как при нахождении в легких, так и при приеме внутрь.
Биотрансформация при участии изоферментов цитохрома Р450 (CYP450) играет незначительную роль в общем метаболическом клиренсе аклидиния бромида.
Испытания in vitro показали, что аклидиния бромид в терапевтической дозе или его метаболиты нс подавляют или не индуцируют какие-либо изоферменты цитохрома Р450 (CYP450) и не подавляют активность эстераз (карбоксилэстеразы, ацетилхолинэстеразы и бутирилхолинэстеразы). Испытания in vitro показали, что аклидиния бромид или его метаболиты не являются субстратами или ингибиторами Р-гликопротеина.
Выведение
Конечный и эффективный периоды полувыведения аклидиния бромида составляют около 14 ч и 10 ч, соответственно, после ингаляции 400 мкг 2 раза/сут пациентами с ХОБЛ.
После в/в введения здоровым добровольцам 400 мкг меченого радиоактивной меткой аклидиния бромида около 1% дозы выводилось в неизмененном виде с мочой.
До 65% дозы выводилось в виде метаболитов с мочой и до 33% в виде метаболитов с калом.
После ингаляционного введения здоровым добровольцам и пациентам с ХОБЛ 200 мкг и 400 мкг аклидиния бромида очень малое количество, около 0.1% принятой дозы, выводилось в неизмененном виде с мочой, что указывает на то, что почечный клиренс играет незначительную роль в общем клиренсе аклидиния из плазмы крови.
Линейность/нелинейность
Аклидиния бромид в терапевтическом диапазоне имеет линейную и независимую от времени фармакокинетику.
Фармакокинетическое/фармакодинамическое соотношение
Учитывая то, что аклидиния бромид обладает местным действием в легких и быстро разрушается в плазме, прямого соотношения между фармакокинетикой и фармакодинамикой нет.
Фармакокинетика у особых групп пациентов
Пациенты пожилого возраста. Фармакокинетические свойства аклидиния бромида у пациентов с ХОБЛ от умеренной до тяжелой степени являются аналогичными у пациентов в возрасте 40-59 лет и у пациентов в возрасте 70 лет и старше. Поэтому у пожилых пациентов с ХОБЛ коррекции дозы не требуется.
Пациенты с нарушением функции печени. У пациентов с нарушением функции печени испытания не проводились. Т.к. аклидиния бромид метаболизируется в основном путем химического и ферментативного расщепления в плазме, очень маловероятно, что нарушение функции печени изменяет его системное воздействие. У пациентов с ХОБЛ и нарушением функции печени коррекции дозы не требуется.
Пациенты с нарушением функции почек. У пациентов с нормальной функцией почек и с ее нарушением значимых различий в фармакокинетике обнаружено не было. Поэтому у пациентов с ХОБЛ и нарушением функции почек коррекции дозы и дополнительного наблюдения не требуется.
Раса. При повторном применении системная экспозиция аклидиния бромида была схожей у пациентов-японцев и пациентов-европеоидов.
Показания препарата Бретарис® Дженуэйр®
- поддерживающая бронходилатирующая терапия с целью облегчения симптомов ХОБЛ у взрослых.
| Код МКБ-10 | Показание |
| J44 | Другая хроническая обструктивная легочная болезнь |
Открыть список кодов МКБ-11
Режим дозирования
Для ингаляционного применения.
Рекомендуемая доза составляет 322 мкг аклидиния (1 ингаляция) 2 раза/сут.
В случае пропуска приема дозы следующую дозу необходимо принять как можно скорее. Однако в случае, если время для приема следующей дозы (после пропуска) почти подошло, пропущенную дозу принимать не следует.
Коррекции дозы препарата у пациентов пожилого возраста не требуется.
Коррекции дозы препарата у пациентов с нарушением функции почек не требуется.
Коррекции дозы препарата у пациентов с нарушением функции печени не требуется.
Способ применения
Пациенты должны быть обучены правильному использованию ингалятора Дженуэйр® .
Инструкция по применению ингалятора Дженуэйр®
Предварительно следует достать ингалятор Дженуэйр® из пакета и ознакомиться с его компонентами.
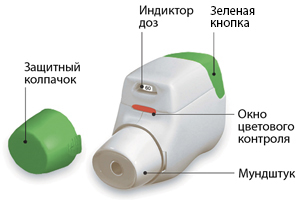
рис. 0
Для использования ингалятора Бретарис® Дженуэйр® после снятия колпачка необходимо сделать 2 шага.
Шаг 1. Нажать и отпустить зеленую кнопку и полностью выдохнуть, но не в ингалятор.
Шаг 2. Плотно обхватить губами мундштук и сильно и глубоко вдохнуть через ингалятор.
После ингаляции не забыть надеть защитный колпачок.
Начало применения
Перед первым применением следует вскрыть закрытый пакет вдоль метки и вынуть ингалятор Дженуэйр®.
При приеме дозы лекарственного препарата следует снять защитный колпачок, слегка сжав стрелки на каждой стороне и потянув колпачок наружу (рис. 1).

Рис. 1
Убедиться в том, что мундштук ничто не блокирует.
Держать ингалятор Дженуэйр® горизонтально мундштуком по направлению к пациенту. Зеленая кнопка должна быть направлена прямо вверх (рис. 2).
| Держать ингалятор зеленой кнопкой обращенной прямо вверх. Не наклонять |

Рис. 2
Шаг 1. Нажать и отпустить зеленую кнопку (рис. 3 и 4).
Не удерживать зеленую кнопку нажатой.
| Нажать зеленую кнопку на всю глубину |

Рис. 3
| Отпустить зеленую кнопку |

Рис. 4
Остановиться и проверить, что доза готова для ингаляции - убедиться, что окно цветового контроля стало зеленым (рис. 5).
Зеленый цвет контрольного окна подтверждает, что лекарственный препарат готов для ингаляции.
| Готов к применению |

Рис. 5
Если окно цветового контроля остается красным, следует нажать и отпустить зеленую кнопку еще раз (см. шаг 1).
Перед тем, как поднести ингалятор ко рту, следует полностью выдохнуть. Не выдыхать в ингалятор.
Шаг 2. Плотно обхватить губами мундштук ингалятора Дженуэйр®, сильно и глубоко вдохнуть через мундштук (рис. 6).
Такой сильный, глубокий вдох доставляет лекарственный препарат через ингалятор в легкие.
| Внимание: во время ингаляции нельзя держать прибор с нажатой зеленой кнопкой кнопкой вниз |

Рис. 6
Во время вдоха пациент услышит щелчок, означающий правильное применение ингалятора Дженуэйр®.
Для того чтобы принять всю дозу, следует продолжать вдыхать даже после того, как будет услышан щелчок ингалятора.
Вынуть ингалятор Дженуэйр® изо рта и задержать дыхание так долго, чтобы было комфортно, затем медленно выдохнуть через нос.
Примечание. Некоторые пациенты, в зависимости от индивидуальных особенностей, могут ощущать легкий сладковатый или горьковатый вкус при ингаляции данного лекарственного препарата. Не следует принимать дополнительную дозу, если пациент не почувствовал никакого вкуса после ингаляции.
Остановиться и проверить, что ингаляция проведена правильно - убедиться, что окно контроля стало красным (рис. 7). Это подтверждает то, что пациент правильно провел ингаляцию полной дозы.
| Ингаляция проведена правильно |

Рис. 7
Если окно цветового контроля остается зеленым, необходимо вновь сильно и глубоко вдохнуть через мундштук (см. шаг 2).
Если окно контроля все еще не изменяет цвет на красный, то возможно, пациент мог забыть отпустить зеленую кнопку перед ингаляцией или мог неправильно вдохнуть. Если это так, следует попробовать вновь - убедиться, что зеленая кнопка отпущена и сделать сильный глубокий вдох через мундштук.
Примечание. Если после нескольких попыток пациенту так и не удалось правильно провести ингаляцию, следует обратиться к лечащему врачу.
Как только окно контроля станет красным, надеть защитный колпачок на мундштук (рис. 8).
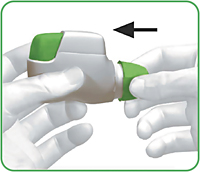
Рис. 8
Когда пациенту необходим новый ингалятор Дженуэйр®
Ингалятор Дженуэйр® оборудован индикатором доз, показывающим, сколько примерно доз осталось в ингаляторе. Индикатор доз медленно опускается, показывая интервалы до 10 (60, 50, 40, 30, 20, 10, 0) (рис. А). Каждый ингалятор Дженуэйр® содержит, по меньшей мере, 30 или 60 доз, в зависимости от вида упаковки.
Когда на индикаторе доз появится лента с красными полосками (рис. А), это означает, что препарат заканчивается и необходимо приобрести новый ингалятор Дженуэйр®.
| Индикатор доз снижается с интервалами по 10: 60, 50, 40, 30, 20, 10, 0 |
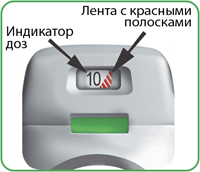
Рис. А
Примечание. Если ингалятор Дженуэйр® окажется поврежден или потеряется колпачок, необходимо заменить ингалятор. Ингалятор Дженуэйр® чистить не нужно. Однако, в случае необходимости, это надо делать с помощью сухой ткани или бумажной салфетки снаружи мундштука. Никогда не использовать воду для чистки ингалятора Дженуэйр®, т.к. это может повредить лекарственный препарат.
Как узнать, что ингалятор Дженуэйр® пуст

Рис. В
Когда в середине индикатора доз появится цифра 0 (ноль), необходимо продолжить применение всех остающихся в ингаляторе Дженуэйр® доз.
Когда для ингаляции будет подготовлена последняя доза, зеленая кнопка не вернется полностью в свое верхнее положение, а останется заблокирована в среднем положении (рис. В). Даже когда зеленая кнопка заблокирована, пациент, тем не менее, сможет принять последнюю дозу. После этого ингалятор Дженуэйр® не может быть использован вновь, будет необходимо начать использовать новый ингалятор Дженуэйр®.
Побочное действие
Наиболее часто встречающимися побочными действиями при применении препарата Бретарис® Дженуэйр® являются головная боль (6.6%) и назофарингит (5.5%).
Частота побочных действий основана на оценке общих коэффициентов возникновения побочных действий (т.е. событий, связанных с применением препарата Бретарис® Дженуэйр®), наблюдаемых при применении препарата Бретарис® Дженуэйр® в дозе 322 мкг (636 пациентов) при пуловом анализе одного 6-месячного и двух 3-х месячных рандомизированных клинических исследований с контролем плацебо.
Частота побочных действий определена следующим образом: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (<1/10000); и частота неизвестна (побочные действия, частота возникновения которых неизвестна, т.е. частоту нельзя оценить, исходя из имеющихся данных).
Инфекционные и паразитарные заболевания: часто - синусит, назофарингит.
Со стороны иммунной системы: редко - реакции гиперчувствительности; частота неизвестна - ангионевротический отек,
анафилактическая реакция.
Со стороны нервной системы: часто - головная боль; нечасто - головокружение.
Со стороны органа зрения: нечасто - нечеткость зрения.
Со стороны сердечно-сосудистой системы: нечасто - тахикардия, ощущение сердцебиения.
Со стороны дыхательной системы, органов грудной клетки и средостения: часто - кашель; нечасто - дисфония.
Со стороны ЖКТ: часто - диарея; нечасто - сухость слизистой оболочки полости рта, стоматит.
Со стороны кожных покровов и подкожных тканей: нечасто - сыпь, кожный зуд.
Со стороны почек и мочевыводящих путей: нечасто - задержка мочи.
Противопоказания к применению
- повышенная чувствительность к аклидиния бромиду или к лактозе;
- непереносимость галактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция (препарат содержит лактозу);
- возраст до 18 лет (эффективность и безопасность не установлены).
Применение при беременности и кормлении грудью
Беременность
Нет клинических данных по применению аклидиния бромида у беременных женщин. Доклинические исследования продемонстрировали токсическое действие на плод только в дозах, во много раз превышающих максимальную терапевтическую дозу у человека. Аклидиния бромид может применяться во время беременности только в том случае, если ожидаемая польза для матери превосходит потенциальный риск для плода.
Период кормления грудью
Неизвестно, проникает ли аклидиния бромид и/или его метаболиты в грудное молоко у женщин. Т.к. доклинические исследования показали, что небольшие количества аклидиния бромида и/или его метаболиты проникают в молоко, необходимо принять решение о прекращении грудного вскармливания, либо о прекращении терапии аклидиния бромидом, сопоставив пользу грудного вскармливания для ребенка и пользу длительной терапии аклидиния бромидом для женщины.
Фертильность
Доклинические исследования продемонстрировали небольшое снижение фертильности только в дозах, во много раз превышающих максимальную терапевтическую дозу аклидиния бромида у человека. Считается маловероятным, что аклидиния бромид, назначенный в рекомендованной дозе, воздействует на фертильность у человека.
Применение при нарушениях функции печени
Коррекции дозы препарата у пациентов с нарушением функции печени не требуется.
Применение при нарушениях функции почек
Коррекции дозы препарата у пациентов с нарушением функции почек не требуется.
Применение у детей
Применение у пожилых пациентов
Особые указания
Парадоксальный бронхоспазм
Как и при другой ингаляционной терапии, применение препарата Бретарис® Дженуэйр® может вызывать парадоксальный бронхоспазм. Если это произошло, то лечение препаратом Бретарис® Дженуэйр® необходимо прекратить и рассмотреть возможность другой терапии.
Усиление симптомов заболевания
Аклидиния бромид предназначен для поддерживающего лечения больных с ХОБЛ и не должен использоваться в качестве препарата экстренной терапии. Если во время лечения аклидиния бромидом у пациента произошло изменение выраженности симптомов ХОБЛ, что потребовало проведения дополнительной экстренной терапии, должна быть проведена повторная оценка состояния пациента и пересмотр тактики лечения.
Влияние на сердечно-сосудистую систему
Профиль безопасности в отношении сердечно-сосудистой системы характеризуется наличием антихолинергического действия.
Как и другие м-холиноблокаторы препарат, препарат Бретарис® Дженуэйр® следует назначать с осторожностью больным, перенесшим инфаркт миокарда в предшествующие 6 месяцев, с нестабильной стенокардией, впервые диагностированной аритмией в предшествующие 3 месяца, или пациентам, в предшествующие 12 месяцев госпитализированным по поводу сердечной недостаточности III и IV функциональных классов по классификации "Нью-Йоркской кардиологической ассоциации", т.к. такие пациенты были исключены из клинических исследований, а антихолинергические эффекты могут оказать влияние на течение указанных заболеваний.
Антихолинергические эффекты
Сухость слизистой оболочки полости рта, наблюдаемая при применении антихолинергических препаратов, с течением времени может быть ассоциирована с развитием кариеса зубов.
В связи с наличием антихолинергических эффектов, аклидиния бромид следует назначать с осторожностью пациентам с закрытоугольной глаукомой (несмотря на то, что прямой контакт препарата с глазами очень маловероятен), гиперплазией предстательной железы и обструкцией шейки мочевого пузыря. Пациенты должны быть проинформированы о признаках и симптомах острого приступа закрытоугольной глаукомы и о необходимости прекратить применение препарата и обратиться к врачу в случае их проявления.
Препарат Бретарис® Дженуэйр® предназначен для поддерживающего лечения больных ХОБЛ. В связи с тем обстоятельством, что в общей популяции ХОБЛ существенно преобладают больные в возрасте старше 40 лет, при назначении препарата пациентам до 40 лет требуется спирометрическое подтверждение диагноза ХОБЛ.
Влияние на способность к управлению транспортными средствами и другими механизмами
Аклидиния бромид может оказывать влияние на способность к управлению транспортными средствами и другими механизмами. Учитывая возможность развития таких побочных эффектов как головная боль, головокружение, нечеткость зрения, следует соблюдать осторожность при управлении транспортными средствам, другими механизмами, а также при занятиях потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
Высокие дозы аклидиния бромида могут приводить к симптомам, связанным с антихолинергическим действием.
Однако, однократная ингаляционная доза аклидиния бромида до 6000 мкг у здоровых добровольцев не приводила к системным побочным антихолинергическим эффектам. Не отмечалось клинически значимых побочных действий после 7-дневного лечения аклидиния бромидом в дозах до 800 мкг 2 раза/сут у здоровых добровольцев.
Развитие острой интоксикации при случайной передозировке аклидиния бромидом является маловероятным вследствие низкой биодоступности при приеме внутрь и ингаляционном способе дозирования препарата Бретарис® Дженуэйр®.
Лечение: симптоматическое.
Лекарственное взаимодействие
Одновременное применение аклидиния бромида с другими М-холиноблокаторами не изучалось и не рекомендуется.
Несмотря на отсутствие исследований in vivo, применение аклидиния бромида для ингаляций возможно в комбинации с другими лекарственными средствами для терапии ХОБЛ, включая симпатомиметики, бронходилататоры, метилксантины и ингаляционные или пероральные ГКС.
Исследования in vitro продемонстрировали, что аклидиния бромид в терапевтической дозе или его метаболиты не взаимодействуют с лекарственными средствами, являющимися субстратами Р-гликопротеина или лекарственными средствами, которые метаболизируются изоферментами цитохрома Р450 (CYP450) и эстеразами.
Условия хранения препарата Бретарис® Дженуэйр®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Бретарис® Дженуэйр®
Срок годности после первого вскрытия пакета - 90 дней.
Условия реализации
Контакты для обращений
Р-ФАРМ АО (Россия)

|
|
123154 Москва, ул. Берзарина, д. 19, корп. 1 |
X



