Кабазитаксел ЭВЕР Фарма® (Cabazitaxel EVER Pharma) инструкция по применению
Владелец регистрационного удостоверения:
Лекарственная форма
|
|
Кабазитаксел ЭВЕР Фарма® |
Концентрат для приготовления раствора для инфузий 10 мг/1 мл: фл. 6 мл
рег. №: ЛП-(003278)-(РГ-RU)
от 26.09.23
- Действующее
|
Форма выпуска, упаковка и состав препарата Кабазитаксел ЭВЕР Фарма®
Концентрат для приготовления раствора для инфузий в виде прозрачного раствора слегка желтоватого цвета.
| 1 мл | 1 фл. | |
| кабазитаксел | 10 мг | 60 мг |
Вспомогательные вещества: полисорбат 80, этанол безводный, макрогол 300, лимонная кислота безводная.
6 мл - флаконы бесцветного стекла вместимостью 10 мл (1) - пачки картонные×.
× дополнительно могут быть нанесены защитные наклейки.
Фармакологическое действие
Механизм действия
Кабазитаксел является противоопухолевым средством, которое действует путем разрушения клеточной сети микротрубочек. Кабазитаксел связывается с тубулином и способствует сборке тубулина в микротрубочки и одновременно ингибирует их разборку. Это приводит к стабилизации микротрубочек, что в итоге ингибирует митотическую и интерфазную активность клетки.
Фармакодинамические эффекты
Кабазитаксел продемонстрировал широкий спектр противоопухолевой активности в отношении поздних стадий опухолей человека, ксенотрансплантированных мышам. Кабазитаксел активен в отношении чувствительных к доцетакселу опухолей. Кроме этого, кабазитаксел показал активность в отношении опухолевых моделей, нечувствительных к химиотерапии, включая доцетаксел.
Клиническая эффективность и безопасность
Взрослые пациенты
Эффективность и безопасность кабазитаксела в комбинации с преднизолоном или преднизоном были оценены в рандомизированном открытом международном многоцентровом исследовании III фазы (исследование EFC6193) у пациентов с метастатическим кастрационно-резистентным раком предстательной железы, ранее получавших режимы химиотерапии, включавших доцетаксел.
Первичной конечной точкой исследования была общая выживаемость (ОВ).
Вторичные конечные точки включали выживаемость без прогрессирования (ВБП), определяемую как время от рандомизации до прогрессирования опухоли, биохимического прогрессирования (по уровню простатического специфического антигена (ПСА)), прогрессии боли или смерти по любой причине, в зависимости от того, что произойдет раньше, частоту ответа опухоли по критериям RECIST (Tumor Response Rate based on Response Evaluation Criteria in Solid Tumors), прогрессию по уровню ПСА (определяемую как ≥25% увеличение или >50% увеличение уровня ПСА у пациентов, не отвечающих и отвечающих на терапию, соответственно), ответ по уровню ПСА (снижение концентрации ПСА в сыворотке крови как минимум на 50%), прогрессию боли (оценивалась с помощью шкалы интенсивности боли (Present Pain Intensity (PPI)) из опросника McGill-Melzack и анальгетической шкалы (Analgesic Score (AS)) и ответ в отношении интенсивности боли (определяемый как снижение в 2 раза по сравнению с базовой медианой значения PPI при отсутствии возрастания баллов по AS, или уменьшением ≥50% в использовании анальгетиков по сравнению с исходным средним значением по шкале AS без одновременного усиления интенсивности боли).
В общей сложности 755 пациентов были рандомизированы для получения терапии кабазитакселом в дозе 25 мг/м2 площади поверхности тела в/в каждые 3 недели в течение максимум 10 циклов в комбинации с преднизолоном или преднизоном в дозе 10 мг/сут ежедневно (количество пациентов 378) или митоксантроном в дозе 12 мг/м2 в/в каждые 3 недели с преднизолоном или преднизоном в дозе 10 мг внутрь ежедневно (количество пациентов 377).
В это исследование включались пациенты старше 18 лет с метастатическим кастрационно-резистентным раком предстательной железы с измеряемыми очагами по критериям RECIST или с неизмеряемыми очагами, но с возрастающим уровнем ПСА или с появлением новых очагов, и с состоянием функциональной активности пациента по ECOG (Eastern Cooperative Oncology Group - Западная Кооперативная Онкологическая группа) от 0 до 2. В исследование включались только пациенты с количеством нейтрофилов >1500/мм3, тромбоцитов >100000/мм3, концентрациями гемоглобина >10 г/дл, креатинина < 1.5×ВГН, общего билирубина < 1×ВГН, АСТ/ГОТС< 1.5 ВГН и АЛТ/ГПТС< 1.5 ВГН. Пациенты с указаниями в анамнезе на застойную сердечную недостаточность или инфаркт миокарда в течение последних 6 месяцев или пациенты с неконтролируемыми нарушениями сердечного ритма, стенокардией и/или артериальной гипертензией в исследование не включались.
Демографические характеристики, включая расовую принадлежность, и состояние функциональной активности по шкале ECOG (0-2) были сбалансированы между группами лечения. В группе кабазитаксела средний возраст пациентов составил 68 лет (46-92 года), а распределение по расовой принадлежности было: 83.9% - европеоиды, 6.9% - монголоиды, 5.3% - негроиды и 4% - другие расы.
Медиана числа циклов составляла 6 циклов в группе кабазитаксела и 4 цикла - в группе митоксантрона. Количество пациентов, получивших запланированные 10 циклов терапии составило 29.4% в группе кабазитаксела и 13.5% - в группе митоксантрона.
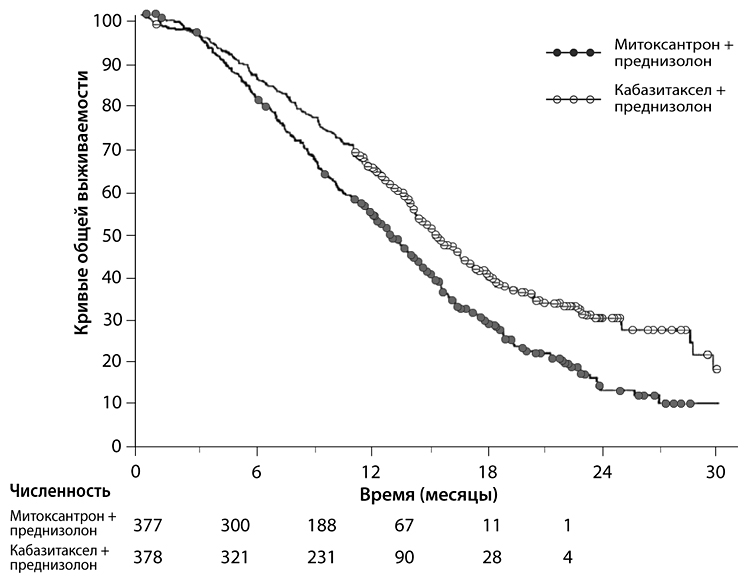
Общая выживаемость была более продолжительной в группе кабазитаксела, риск смерти снизился на 30% в группе кабазитаксела по сравнению с группой митоксантрона (отношение рисков=0.70, 95% ДИ (0.59-0.83)) (см. Таблица 1 и Рисунок 1).
Таблица 1. Эффективность кабазитаксела в исследовании EFC6193 при лечении пациентов с метастатическим кастрационно-резистентным раком предстательной железы
| Кабазитаксел + преднизолон n=378 | Митоксантрон + преднизолон n=377 | |
| Общая выживаемость | ||
| Число пациентов с летальными исходами (%) | 234 (61.9%) | 279 (74%) |
| Медиана выживаемости (месяцы) (95% ДИ) | 15.1 (14.1-16.3) | 12.7 (11.6-137) |
| Отношение рисков (ОР)1 (95% ДИ) | 0.70 (0.59-0.83) | |
| р-значение | < 0.0001 | |
1 ОР оценивалось с использованием Сох-модели; отношение рисков менее чем 1 свидетельствует в пользу кабазитаксела.
Рисунок 1. Кривые общей выживаемости каплан-Мейера (исследование EFC6193)
Выживаемость без прогрессирования в группе кабазитаксела по сравнению с группой митоксантрона составила 2.8 (2.4-3.0) месяца против 1.4 (1.4-1.7), соответственно, ОР (95% ДИ) 0.74 (0.64-0.86), р< 0.0001.
Частота ответа опухоли в группе кабазитаксела была достоверно выше и составила 14.4% (95% ДИ: 9.6-19.3) против 4.4% (95% ДИ: 1.6-7.2) в группе пациентов, получавших терапию митоксантроном, р=0.0005.
Преимущество кабазитаксела было продемонстрировано в отношении вторичных конечных точек, оцененных по изменению уровня ПСА. Медиана прогрессирования по уровню ПСА составила 6.4 месяцев (95% ДИ: 5.1-7.3) для пациентов в группе кабазитаксела по сравнению с 3.1 месяцами (95% ДИ: 2.2-4.4) в группе митоксантрона, ОР 0.75 месяцев (95% ДИ: 0.63-0.90), р=0.0010. Ответ в отношении уровня ПСА был отмечен у 39.2% пациентов в группе кабазитаксела (95% ДИ: 33.9-44.5) против 17.8% у пациентов в группе митоксантрона (95% ДИ: 13.7-22.0), р=0.0002.
Митоксантрон показан для терапии пациентов с гормонорезистентным раком предстательной железы с болевым синдромом. Не было отмечено статистически значимых различии в обеих группах в отношении прогрессии боли или частоты ответа в отношении уровня боли.
В многоцентровом многонациональном рандомизированном открытом исследовании дизайна "non-inferiority" III фазы (исследование EFC11785) 1200 пациентов с метастатическим кастрационно-резистентным раком предстательной железы, ранее получавших химиотерапию, содержащую доцетаксел, были рандомизированы на 2 группы: терапия кабазитакселом в дозе 25 мг/м2 (n=602) или в дозе 20 мг/м2 (n=598). Первичной конечной точкой исследования была ОВ.
Исследование достигло первичной конечной точки, продемонстрировав не меньшую эффективность кабазитаксела в дозе 20 мг/м2 по сравнению с дозой 25 мг/м2 (см. Таблицу 2). Частота ответа по ПСА была статистически достоверно выше в группе кабазитаксела 25 мг/м2 (42.9%) по сравнению с группой 20 мг/м2 (29.5%), р< 0.001.
В группе кабазитаксела 20 мг/м2 риск прогрессирования по ПСА был статистически достоверно выше, чем в группе пациентов с дозой 25 мг/м2 (ОР 1.195; 95% ДИ: 1.025-1.393). Статистически достоверного различия между группами сравнения в отношении других вторичных конечных точек отмечено не было (выживаемость без прогрессирования, ответ опухоли и ответ в отношении боли, прогрессия опухоли и боли, 4 подкатегории функциональной оценки противоопухолевой терапии предстательной железы (FACT-P)).
Таблица 2. Общая выживаемость в исследовании EFC11785 в группе кабазитаксела 25 мг/м2 по сравнению с группой кабазитаксела 20 мг/м2
| Кабази20 + П (n=598) | Кабази25 + П (n=602) | |
| Общая выживаемость | ||
| Случаи смерти, n (%) | 497 (83.1%) | 501 (83.2%) |
| Медиана ОВ (95% ДИ) (месяцы) | 13.4 (12.19-14.88) | 14.5 (13.47-15.28) |
| Отношение рисковα | ||
| против Кабази25 + П | 1.024 | - |
| 1-сторонний 98.89% UCI | 1.184 | - |
| 1-сторонний 95% LCI | 0.922 | - |
Кабази20 = кабазитаксел 20 мг/м2, Кабази25 = кабазитаксел 25 мг/м2, П = преднизолон/преднизон, ДИ = доверительный интервал, LCI = нижняя граница доверительного интервала, UCI = верхняя граница доверительного интервала, ОВ - общая выживаемость.
α - Отношение рисков оценивалось с использованием Cox Proportional Hazard model.
Соотношение < 1 указывает на меньший риск в группе кабазитаксела в дозе 20 мг/м2 по сравнению с дозой 25 мг/м2.
Исследование EFC11785 показало лучший профиль безопасности у кабазитаксела в дозе 20 мг/м2. Профиль безопасности кабазитаксела 25 мг/м2, наблюдавшийся в этом исследовании, был количественно и качественно схож с профилем безопасности, наблюдавшемся в исследовании EFC6193. Медиана количества курсов терапии кабазитакселом пациентов в группе 20 мг/м2 составила 6 курсов (медиана длительности терапии - 18 недель), в то время как медиана терапии в группе 25 мг/м2 - 7 циклов (медиана длительности терапии - 21 неделя). В группе кабазитаксела 25 мг/м2 у 128 пациентов (21.5%) доза лекарственного препарата была снижена с 25 до 20 мг/м2, у 19 пациентов (3.2%) доза кабазитаксела снижена с 20 до 15 мг/м2 и у 1 пациента (0.2%) доза лекарственного препарата была снижена с 15 до 12 мг/м2. В группе кабазитаксела 20 мг/м2 у 58 пациентов (10.0%) доза была снижена с 20 до 15 мг/м2 и у 9 пациентов (1.6%) с 15 до 12 мг/м2. Все НР любой степени тяжести с частотой более 10% отмечались чаще у пациентов, получавших 25 мг/м2, чем у пациентов, получавших 20 мг/м2: диарея (39.8% против 30.7%), тошнота (32.1% против 24.5%), слабость (27.1% против 24.7%), гематурия (20.8% против 14.1%), астения (19.7% против 15.3%), пониженный аппетит (18.5% против 13.1%), рвота (18.2% против 14.5%), запор (18.0% против 17.6%), боль в спине (13.9% против 11.0%), клиническая нейтропения (10.9% против 3.1%), инфекция мочевыводящих путей (10.8% против 6.9%), периферическая сенсорная нейропатия.(10.6% против 6.6%) и дисгевзия (10.6% против 7.1%). НР со степенью тяжести ≥3 с частотой больше 5% наблюдались только у пациентов, получавших дозу 25 мг/м2: клиническая нейтропения (9,6 % при 25 мг/м2 против 2,4 % при 20 мг/м2) и фебрильная нейтропения (9,2 % при 25 мг/м2 против 2,1 % при 20 мг/м2). Согласно лабораторным данным меньшее количество нарушений гематологических показателей отмечалось у пациентов, получавших кабазитаксел 20 мг/м2, по сравнению с пациентами, получавших 25 мг/м2: 73.3% при 25 мг/м2 против 41.8% при 20 мг/м2 для нейтропении ≥3 степени тяжести, 13.7% против 9.9%, соответственно, для анемии ≥3 степени тяжести, 4.2% против 2.6%, соответственно, для тромбоцитопении ≥3 степени тяжести.
Дети
Кабазитаксел оценивался в многоцентровом открытом исследовании, проводимом в двух фазах (n=39). В 1-й фазе была подобрана максимально переносимая доза (MTD) кабазитаксела у детей (в возрасте 4-18 лет) с рецидивирующими или рефрактерными солидными опухолями на основании дозолимитирующей токсичности (DLTs). Во 2-й фазе исследования была оценена активность и безопасность применения кабазитаксела в максимально переносимой дозе у детей (в возрасте 3-16 лет) с рецидивирующей или рефрактерной глиомой высокой степени злокачественности или с диффузной глиомой моста головного мозга. Первичными конечными точками 2-й фазы исследования являлись определение частоты объективных ответов и длительности ответа.
Все пациенты получали профилактику Г-КСФ. В 1-й фазе исследования 23 пациента получили кабазитаксел в дозах от 20 мг/м2 до 35 мг/м2. Максимально переносимая доза составила 30 мг/м2.
Во 2-й фазе исследования 16 пациентов получили кабазитаксел в дозе 30 мг/м2. Эффективность терапии была оценена у 11 пациентов. У пациентов с диффузной глиомой моста головного мозга и глиомой высокой степени злокачественности не было отмечено объективных ответов на терапию.
Самыми частыми НР любой степени тяжести, возникающими на фоне лечения (≥25%) были слабость (39.1%), головная боль, диарея, тошнота (в целом 34.8%), рвота (30.4%) и запор (26.1%) в 1-й фазе исследования; диарея (43.8%), дисфагия (37.5%), тошнота (31.3%), рвота и головная боль (обе у 25.0%) у пациентов во 2-й фазе исследования.
Серьезные НР, отмечавшиеся более чем у 2 пациентов в любой фазе исследования, включали в себя: в 1-й фазе - фебрильная нейтропения у 5 пациентов (21.7%) и во 2-й фазе - фебрильная нейтропения, анафилактическая реакция и прогрессирование заболевания у 3 пациентов (18.8%).
Фармакокинетика
Популяционный анализ фармакокинетических показателей проводился у пациентов с местно-распространенными солидными опухолями, метастатическим раком молочной железы и метастатическим раком предстательной железы. Эти пациенты получали кабазитаксел в диапазоне доз 10-30 мг/м2 площади поверхности тела еженедельно или каждые 3 недели.
Всасывание
После одночасовой в/в инфузии кабазитаксела в дозе 25 мг/м2 площади поверхности тела у пациентов с метастатическим раком предстательной железы Cmax кабазитаксела в плазме крови достигалась к концу одночасовой инфузии Tmax, среднее значение Cmax составляло 226 нг/мл. Среднее значение AUC составляло 991 нг×ч/мл.
У пациентов с местно-распространенными солидными опухолями не наблюдалось больших отклонений в дозопропорциональности концентраций кабазитаксела в плазме крови в диапазоне доз 10-30 мг/м2 площади поверхности тела.
Распределение
Объем распределения в равновесном состоянии (Vss) составлял 4870 л (2640 л/м2 для пациентов с медианой площади поверхности тела, составляющей 1.84 м2).
In vitro связь кабазитаксела с человеческими сывороточными белками составляла 89-92% и была ненасыщаемой до концентрации 50000 нг/мл, которая превышает Cmax, наблюдавшуюся при клиническом применении препарата. Кабазитаксел, главным образом, связывается с сывороточным альбумином (82.0%) и липопротеинами (87.9% для ЛПВП, 69.8% для ЛПНП и 55.8% для ЛПОНП). In vitro в человеческой крови соотношение концентрации в крови и концентрации в плазме крови находится в диапазоне 0.90-0.99, что указывает на одинаковое распределение кабазитаксела в крови и плазме крови. Исследования, проведенные на животных, показали, что кабазитаксел и его метаболиты экскретируются в грудное молоко, а кабазитаксел также проникает через плацентарный барьер.
Метаболизм
Кабазитаксел интенсивно метаболизируется в печени (≥95%), главным образом, с помощью изоферментов подсемейства CYP3A (80-90%). Кабазитаксел является основным соединением, циркулирующим в плазме крови. Помимо него, в плазме крови было идентифицировано 7 метаболитов (включая 3 активных метаболита, образующихся в результате O-деметилирования). Концентрация в плазме крови главного из этих метаболитов составляет 5% от концентрации в плазме крови неизмененного кабазитаксела. Около 20 метаболитов кабазитаксела выводятся с мочой и калом.
По данным исследований in vitro потенциальный риск ингибирования кабазитакселом печеночного метаболизма в клинически значимых концентрациях возможен в отношении препаратов, которые, главным образом, являются субстратами изоферментов подсемейства CYP3A. Однако, отсутствует какой-либо потенциальный риск ингибирования метаболизма препаратов, которые являются субстратами других изоферментов CYP (CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2E1 и CYP2D6). Также in vitro кабазитаксел не индуцирует изофермент CYP2C9 и изоферменты подсемейства CYP1A и CYP3A. Исследования по взаимодействию, проведенные у человека, показали, что кабазитаксел (вводимый в виде одночасовой в/в в дозе 25 мг/м2 площади поверхности тела) не изменял плазменных концентраций мидазолама, эталонного субстрата изоферментов подсемейства CYP3A. Таким образом, in vivo кабазитаксел не ингибирует изоферменты подсемейства CYP3 A.
Сильные индукторы или ингибиторы изоферментов подсемейства CYP3A могут изменять плазменные концентрации кабазитаксела в плазме крови, т.к. кабазитаксел в основном метаболизируется с помощью изоферментов подсемейства CYP3A.
Преднизолон, принимаемый в дозе 10 мг/сут, не изменяет фармакокинетику кабазитаксела. In vitro кабазитаксел не ингибирует белки множественной резистентности к химиотерапевтическим препаратам (MRP1 и MRP2) или транспортер органических катионов (ОСТ1). Кабазитаксел ингибирует транспорт Р-гликопротеина (Pgp) (дигоксин, винбластин), белков резистентности к химиотерапевтическим препаратам при раке молочной железы (BCRP) (метотрексат) и полипептидов, транспортирующих органические анионы (ОАТР1ВЗ) (холецистокинин - ССК8), в концентрациях, как минимум, в 15 раз превышающих концентрации, наблюдаемые в клинических условиях, а также ингибирует транспорт ОАТР1В1 (эстрадиол-17β-глюкуронид) в концентрациях, только в 5 раз превышающих наблюдаемые в клинических условиях. Поэтому в дозе 25 мг/м2 площади поверхности тела риск взаимодействия кабазитаксела in vivo с субстратами MRP, ОСТ1, Pgp, BCRP и ОАТР1ВЗ маловероятен. Риск взаимодействия кабазитаксела с транспортером ОАТР1В1 возможен, в особенности, во время проведения в/в инфузии (1 ч) и до 20 мин после окончания инфузии (см. раздел "Лекарственное взаимодействие").
Выведение
После одночасовой в/в инфузии [14С]-кабазитаксела (меченого радиоизотопом кабазитаксела) в дозе 25 мг/м2 площади поверхности тела у онкологических пациентов приблизительно 80% введенной дозы выводится в течение 2 недель. Кабазитаксел, главным образом, выводится из организма через кишечник (с калом) в виде многочисленных метаболитов (76% дозы); в то время как почечная экскреция кабазитаксела и его метаболитов составляет менее 4% от введенной дозы (2.3% введенной дозы выводится с мочой в неизмененном виде).
Кабазитаксел имеет высокий плазменный клиренс, составляющий 48.5 л/ч (26.44 л/ч/м2 площади поверхности тела у пациентов с медианой площади поверхности тела 1.84 м2), и длительный T1/2, составляющий 95 ч.
Фармакокинетика у особых групп пациентов
Пациенты пожилого возраста. При популяционном анализе фармакокинетических данных пациентов в возрасте 65 лет и старше не наблюдалось какого-либо влияния возраста на фармакокинетику кабазитаксела.
Печеночная недостаточность. Кабазитаксел выводится из организма в основном путем печеночного метаболизма. Печеночная недостаточность легкой (общий билирубин сыворотки крови >1 и ≤ 1.5×ВГН или ACT сыворотки крови >1.5×ВГН) и средней (общий билирубин >1.5 и ≤ 3.0×ВГН) степени тяжести не оказывала влияния на фармакокинетику кабазитаксела у пациентов в специальном исследовании. У пациентов с печеночной недостаточностью тяжелой степени (общий билирубин >3.0×ВГН) наблюдалось снижение клиренса кабазитаксела на 39%, что указывает на влияние тяжелой степени печеночной недостаточности на фармакокинетику препарата.
Почечная недостаточность. Кабазитаксел незначительно выводится почками (2.3% от дозы). Популяционный фармакокинетический анализ, проведенный по данным 170 пациентов, в составе которых было 59 пациентов с почечной недостаточностью легкой степени тяжести (КК 50-80 мл/мин) и 14 пациентов с почечной недостаточностью средней степени тяжести (КК 30-50 мл/мин) показал, что почечная недостаточность легкой и средней степени тяжести не оказывала существенного влияния на фармакокинетику кабазитаксела. Это было подтверждено сравнительным исследованием фармакокинетики у пациентов с солидными опухолями с нормальной функцией почек (8 пациентов), пациентов с почечной недостаточностью средней степени тяжести (8 пациентов) и пациентов с почечной недостаточностью тяжелой степени (9 пациентов), которые получали лечение кабазитакселом в виде в/в инфузии в дозе до 25 мг/м2 площади поверхности тела. В исследовании было два пациента с КК< 15 мл/мин/1.73 м2 (8 мл/мин/1.73 м2 и 14 мл/мин/1.73 м2). Следовательно, имеются ограниченные данные о применении кабазитаксела у пациентов с терминальной стадией почечной недостаточности. Результаты исследования фармакокинетики и безопасности кабазитаксела на 8 пациентах показали, что тяжелая почечная недостаточность не оказывала значительного влияния на фармакокинетику и безопасность кабазитаксела.
Фармакокинетическое взаимодействие с другими лекарственными средствами
Кабазитаксел, главным образом, метаболизируется с помощью изоферментов подсемейства CYP3A.
Курсовой прием кетоконазола (400 мг 2 раза/сут), сильного ингибитора изоферментов подсемейства CYP3A, приводил к уменьшению клиренса кабазитаксела на 20% с соответствующим увеличением его AUC на 25%. Одновременное применение апрепитанта, умеренного ингибитора изоферментов подсемейства CYP3A, не оказывало эффекта на клиренс и системную экспозицию кабазитаксела.
Курсовой прием рифампина (600 мг 1 раз/сут), сильного индуктора изоферментов подсемейства CYP3A, приводил к увеличению клиренса на 21% и соответствующему уменьшению AUC на 17%.
Дети
Безопасность и эффективность кабазитаксела у детей и подростков до 18 лет не установлены.
Данные доклинической безопасности
Общая токсичность
Влияние на печень. Гиперплазия желчных протоков, артериальный/периартериальный некроз и/или гепатоцеллюлярный некроз наблюдались у собак после однократного введения дозы (0.25 мг/кг (5 мг/м2)), 5-дневного введения (0.2 мг/кг (4 мг/м2)) и еженедельного введения (0.325 мг/кг (6.5 мг/м2)). У крыс наблюдалась пигментация клеток Купффера и дегенерация/регенерация желчных протоков в печени при воздействии кабазитаксела в наивысшей летальной дозе, составляющей 10 мг/кг (60 мг/м2), в исследовании на крысах продолжительностью 10 циклов терапии.
Нейротоксичность
У мышей через 10 или 20 недель после однократного введения наблюдалась необратимая периферическая нейротоксичность, гистологически характеризующаяся дегенерацией седалищных нервов и корешков пояснично-крестцовых нервов. Доза, при которой не наблюдалось неблагоприятных эффектов (NOEL), составляла 15 мг/кг (45 мг/м2) после однократного в/в ведения в течение 1 ч.
У мышей отмечалась центральная нейротоксичность, гистопатологически характеризующаяся некрозом и/или вакуолизацией нейронов в головном мозге, аксональным отеком и дегенерацией шейного отдела спинного мозга, после однократной одночасовой в/в инфузии в дозе 15 мг/кг (45 мг/м2), считающейся достаточной для превышения максимальной экспозиции препарата у человека. Доза, при которой не наблюдалось неблагоприятных эффектов (NOEL), составляла 10 мг/кг (30 мг/м2) (приблизительно 7-кратное превышение AUC у пациентов с раком при использовании в рекомендованной у человека дозе) после однократного в/в введения в течение 1 ч.
Нарушения со стороны глаз
Субкапсульный отек/дегенерация волокон хрусталика наблюдался у крыс в течение 10-циклового исследования по токсичности в дозах 10-20 мг/кг (60-120 мг/м2) (приблизительно 2-кратное превышение AUC у пациентов с раком при использовании препарата в рекомендованных у человека дозах). Доза, при которой не наблюдалось неблагоприятных эффектов (NOEL) на хрусталик, составляла 5 мг/кг (30 мг/м2) (приблизительно AUC у пациентов с раком в рекомендованных у человека дозах). Эти эффекты были необратимыми через 8 недель.
Оценка риска для окружающей среды
Результаты оценки риска на окружающую среду показали, что кабазитаксел не обладает каким-либо значимым воздействием на окружающую среду.
Канцерогенность
Длительные исследования на животных для оценки канцерогенного потенциала кабазитаксела не проводились.
Мутагенность
Бактериальный тест обратимой мутагенности (тест Эймса) для кабазитаксела отрицательный.
Генотоксичность
Для кабазитаксела не отмечено кластогенности в in vitro тесте с лимфоцитами человека (кабазитаксел не индуцировал структурных хромосомных аберраций, но увеличивал количество полиплоидных клеток) и индуцировал увеличение микроядер in vivo у крыс в дозах ≥0.5 мг/кг. Однако, эти данные по генотоксичности присущи фармакологической активности соединения (ингибирования деполимеризации тубулина).
Тератогенность
Доклинические исследования на крысах и кроликах показали, что кабазитаксел обладает эмбриотоксическим, фетотоксическим и абортирующим действием. Когда самкам крыс с 6 по 17 день гестации в/в вводили кабазитаксел 1 раз/сут, наблюдалась эмбриофетальная токсичность при меньшей системной экспозиции, чем наблюдаемой у людей, получавших клинически значимые дозы кабазитаксела, и проявлялась в виде гибели плода и снижении среднего веса эмбрионов, связанного с задержкой оссификации скелета. Кабазитаксел не вызывал аномалии развития плода у крыс и кроликов. Кабазитаксел проникал через плацентарный барьер у крыс.
После однократного в/в введения [14С]-кабазитаксела в дозе 0.08 мг/кг самкам крыс в период лактации в материнском молоке в течение 24 ч обнаруживалось менее 1.5% введенной дозы.
Нарушения фертильности
Кабазитаксел не влияет на способность к спариванию или фертильность получавших его в дозах 0.05, 0.1 и 0.2 мг/кг/сут самцов крыс. Однако, во многоцикловых исследованиях на крысах, получавших внутривенно кабазитаксел в дозе 5 мг/кг, наблюдались дегенерация семенных пузырьков и атрофия семенных канальцев, а у собак, получавших кабазитаксел в дозе 0.5 мг/кг - минимальная тестикулярная дегенерация (минимальный некроз одиночных эпителиальных клеток в эпидидимисе). Системная экспозиция у животных была подобной или более низкой, чем таковая, наблюдавшаяся у человека при применении клинически значимых доз кабазитаксела.
Показания препарата Кабазитаксел ЭВЕР Фарма®
Кабазитаксел ЭВЕР Фарма® показан к применению у взрослых:
- терапия метастатического кастрационно-резистентного рака предстательной железы у пациентов, ранее получавших химиотерапию с включением доцетаксела (в комбинации с преднизолоном).
| Код МКБ-10 | Показание |
| C61 | Злокачественное новообразование предстательной железы |
Режим дозирования
Применение препарата Кабазитаксел ЭВЕР Фарма® должно проводиться только в специализированных онкологических отделениях под наблюдением врача, имеющего специальную подготовку по проведению противоопухолевой химиотерапии. В отделении должны быть необходимые условия и медикаменты для оказания помощи при возникновении реакций гиперчувствительности, включая снижение АД и бронхоспазм (см. раздел "Особые указания").
Премедикация
Для уменьшения риска развития и тяжести реакций повышенной чувствительности перед введением препарата Кабазитаксел ЭВЕР Фарма® проводится премедикация следующими вводимыми в/в лекарственными препаратами:
- антигистаминные препараты (дексхлорфенирамин 5 мг или дифенгидрамин 25 мг или аналогичный препарат в эквивалентных дозах);
- глюкокортикостероиды (дексаметазон 8 мг или эквивалентные дозы другого глюкокортикостероида);
- блокаторы гистаминовых H2-рецепторов (ранитидин или аналогичный препарат в эквивалентных дозах) (см. раздел "Особые указания").
Рекомендуется профилактическое применение противорвотных средств внутрь или, при необходимости, в/в.
Режим дозирования
Рекомендованная доза препарата Кабазитаксел ЭВЕР Фарма® составляет 25 мг/м2 площади поверхности тела, которая вводится путем одночасовой в/в инфузии каждые 3 недели в комбинации с приемом внутрь преднизолона 10 мг ежедневно в течение всего периода лечения препаратом Кабазитаксел ЭВЕР Фарма®.
Коррекция вводимой дозы Рекомендуемые изменения вводимой дозы из-за развития неблагоприятных реакций у пациентов, получающих кабазитаксел.
| Неблагоприятные реакции | Изменение вводимой дозы |
| Длительная (более 1 недели) нейтропения ≥3 степени тяжести, несмотря на применение соответствующего лечения, включая введение гранулоцитарного колониестимулирующего фактора (Г-КСФ) | Отсрочка следующего цикла лечения до восстановления количества нейтрофилов в периферической крови до >1500 клеток/мм3, затем снижение дозы в последующих циклах с 25 мг/м2 площади поверхности тела до 20 мг/м2 площади поверхности тела |
| Фебрильная нейтропения или нейтропеническая инфекция | Отсрочка следующего цикла лечения до уменьшения или разрешения фебрильной нейтропении и до восстановления количества нейтрофилов в периферической крови до >1500 клеток/мм3, затем снижение дозы в последующих циклах с 25 мг/м2 площади поверхности тела до 20 мг/м2 площади поверхности тела |
| Диарея ≥3 степени тяжести или упорно продолжающаяся диарея, несмотря на проведение соответствующей терапии и восполнение потерь жидкости и электролитов | Отсрочка следующего цикла лечения до уменьшения или разрешения диареи, затем снижение дозы в последующих циклах с 25 мг/м2 площади поверхности тела до 20 мг/м2 площади поверхности тела |
| Периферическая невропатия ≥2 степени тяжести | Отсрочка лечения до уменьшения симптомов, затем снижение дозы в последующих циклах с 25 мг/м2 площади поверхности тела до 20 мг/м2 площади поверхности тела |
Если у пациента при введении препарата в дозе 20 мг/м2 площади поверхности тела продолжают возникать любые из указанных выше реакций, то рекомендуется снизить дозу препарата Кабазитаксел ЭВЕР Фарма® до 15 мг/м2 площади поверхности тела или рассмотреть вопрос о прекращении лечения препаратом Кабазитаксел ЭВЕР Фарма®. Данные о применении препарата в дозе менее 20 мг/м2 площади поверхности тела ограничены.
Особые группы пациентов
Пациенты пожилого возраста
Не требуется специальной коррекции режима дозирования при применении препарата Кабазитаксел ЭВЕР Фарма® у пациентов пожилого возраста (см. разделы "Особые указания", "Фармакокинетика").
Пациенты с печеночной недостаточностью
Кабазитаксел, в основном, метаболизируется печенью.
У пациентов с печеночной недостаточностью легкой степени тяжести (общий билирубин сыворотки крови >1 до ≤ 1.5×ВГН или ACT сыворотки крови >1.5×ВГН) дозу кабазитаксела следует снизить до 20 мг/м2 площади поверхности тела, при этом требуется соблюдать осторожность, тщательно контролировать состояние пациентов и проводить мониторинг нежелательных реакций.
У пациентов с печеночной недостаточностью средней степени тяжести (общий билирубин сыворотки крови >1.5 до ≤3×ВГН) максимальная переносимая доза кабазитаксела составляет 15 мг/м2 площади поверхности тела. Если предусмотрено лечение пациентов с печеночной недостаточностью средней степени тяжести доза кабазитаксела не должна превышать 15 мг/м2 площади поверхности тела. Однако, имеются ограниченные данные об эффективности этой дозы.
Препарат Кабазитаксел ЭВЕР Фарма® противопоказан пациентам с печеночной недостаточностью тяжелой степени (общий билирубин сыворотки крови >3×ВГН ) (см. разделы "Противопоказания", "Особые указания", "Фармакокинетика").
Пациенты с почечной недостаточностью
Кабазитаксел выводится почками в минимальной степени.
Не требуется коррекции режима дозирования у пациентов с почечной недостаточностью без проведения гемодиализа. Однако, у пациентов с терминальной стадией почечной недостаточности (КК< 15 мл/мин/1.73 м2), в связи с их состоянием и ограниченными данными, лечение следует проводить с осторожностью и при тщательном медицинском контроле во время лечения.
Одновременное применение кабазитаксела с индукторами и ингибиторами изоферментов подсемейства CYP3A
Следует избегать одновременного применения лекарственных средств, которые являются сильными индукторами изоферментов подсемейства CYP3A или сильными ингибиторами изоферментов подсемейства CYP3A. Однако, если пациенту необходимо одновременное применение кабазитаксела и сильных ингибиторов изоферментов подсемейства CYP3A, следует рассмотреть вопрос о снижении дозы кабазитаксела на 25% (см. разделы "Лекарственное взаимодействие" и "Фармакокинетика").
Дети
Безопасность и эффективность препарата Кабазитаксел ЭВЕР Фарма® у детей в возрасте от 0 до 18 лет на данный момент не установлены. Имеющиеся на сегодняшний день данные приведены в разделе "Фармакологическое действие", однако, невозможно дать рекомендации по режиму дозирования.
Способ применения
В/в инфузия.
Меры предосторожности, принимаемые перед применением препарата или при обращении с ним
Как и при работе с другими противоопухолевыми препаратами, следует соблюдать осторожность и использовать перчатки при работе с препаратом Кабазитаксел ЭВЕР Фарма® и приготовлении его инфузионного раствора. Если раствор препарата Кабазитаксел ЭВЕР Фарма® на любом этапе работы с ним попал на кожу, следует немедленно и тщательно промыть место контакта водой с мылом. При попадании препарата на слизистые оболочки следует немедленно и тщательно промыть их водой. Работать с препаратом Кабазитаксел ЭВЕР Фарма® должен только персонал, владеющий навыками обращения с цитотоксическими препаратами.
Беременные женщины не должны работать с этим препаратом.
Следует внимательно прочитать всю нижеследующую информацию по подготовке препарата для в/в введения перед его смешиванием и разведением.
Перед введением препарат Кабазитаксел ЭВЕР Фарма® необходимо развести 1 раз. Необходимо следовать инструкциям по приготовлению, представленным ниже.
Следующий процесс разведения для приготовления раствора для инфузий необходимо проводить в асептических условиях.
Этапы приготовления раствора для инфузий
Этап 1:асептически извлекают необходимое количество концентрата (10 мг/мл кабазитаксела) градуированным шприцем с иглой. Например, для приготовления дозы 45 мг препарата Кабазитаксел ЭВЕР Фарма® потребуется 4.5 мл концентрата.
Кабазитаксел ЭВЕР Фарма®, концентрат для приготовления раствора для инфузий, 10 мг/мл, содержит избыток препарата. Этот избыток обеспечивает извлекаемый объем 4.5 мл, 5 мл или 6 мл с содержанием 10 мг/мл кабазитаксела.
Этап 2:вводят содержимое шприца в стерильный контейнер без ПВХ, содержащий либо 5% раствор глюкозы, либо 0.9% раствор натрия хлорида для инфузий. Концентрация раствора для инфузий должна составлять от 0.10 мг/мл до 0.26 мг/мл.
Этап 3: вынимают шприц и перемешивают содержимое пакета или флакона для инфузий вручную, колебательными движениями.
Этап 4:как и в случае со всеми препаратами для парентерального введения, полученный раствор для инфузий необходимо визуально проверить перед введением. Поскольку раствор для инфузий перенасыщенный, с течением времени он может кристаллизоваться. В таком случае раствор нельзя использовать, его необходимо утилизировать.
Раствор для инфузий необходимо использовать немедленно.
Во время в/в введения инфузионного раствора кабазитаксела необходимо использовать вставленный в систему для в/в инфузий фильтр с номинальным диаметром пор 0.22 мкм.
Препарат Кабазитаксел ЭВЕР Фарма® содержит в своем составе полисорбат 80, который, как известно, увеличивает скорость экстракции ди-(2-этилгексил) фталата из ПВХ. В связи с этим нельзя использовать контейнеры для инфузионных жидкостей из ПВХ и наборы для проведения в/в инфузий из полиуретана для приготовления и введения инфузионного раствора кабазитаксела.
Препарат Кабазитаксел ЭВЕР Фарма® нельзя смешивать ни с какими другими лекарственными препаратами, кроме указанных.
Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
Для введения назначенной дозы может потребоваться более одного флакона концентрата.
Побочное действие
Резюме профиля безопасности
Безопасность кабазитаксела в комбинации с преднизолоном/преднизоном оценивалась у 371 пациента с метастатическим кастрационно-резистентным раком предстательной железы. Медиана полученных пациентами циклов кабазитаксела составляла 6 циклов. Очень часто встречающимися (≥10%) НР всех степеней тяжести были анемия, лейкопения, нейтропения, тромбоцитопения, диарея, повышенная утомляемость, тошнота, рвота, запор, астения, абдоминальные боли, гематурия, боли в позвоночнике, артралгия, анорексия, периферическая невропатия (включая периферическую сенсорную и моторную невропатии), лихорадка, одышка, дисгевзия, кашель, алопеция.
Часто встречающимися (≥5%) НР ≥3 степени тяжести при применении кабазитаксела были нейтропения, лейкопения, анемия, фебрильная нейтропения, диарея, повышенная утомляемость и астения.
Прекращение лечения вследствие развития НР имело место у 68 (18.3%) пациентов, получавших лечение кабазитакселом. Наиболее часто встречающимися НР, приводящими к прекращению лечения кабазитакселом, были нейтропения и почечная недостаточность. Наиболее частыми НР, приводящими к смерти у пациентов, получавших лечение кабазитакселом, были инфекции. Большинство НР в виде развития летальных инфекций возникало после однократного введения кабазитаксела.
Табличное резюме нежелательных реакций
Ниже представлены НР, разделенные по системно-органным классам согласно классификации Медицинского словаря для нормативно-правовой деятельности (MedDRA). Тяжесть НР классифицировалась в соответствии с Общепринятыми терминологическими критериями для НР (СТСАЕ 4.0) (степень тяжести ≥3 = G≥3).
Использовалась классификация частоты возникновения НР ВОЗ: очень часто (≥1/10); часто (≥1/100, но < 1/10); нечасто (≥1/1000, но < 1/100); редко (≥1/10000, но < 1/1000); очень редко (< 1/10000); частота неизвестна (на основании имеющихся данных оценить невозможно).
В пределах каждой группы по частоте встречаемости HP, последние даны в порядке уменьшения их серьезности.
| Очень часто | Часто | Нечасто | Частота неизвестна |
| Инфекции и инвазии | |||
| Септический шок (все случаи ≥3 степени тяжести); сепсис (все случаи ≥3 степени тяжести); воспаление подкожно-жировой клетчатки, инфекции мочевыводящих путей всех степеней тяжести; грипп; цистит; инфекции верхних дыхательных путей; инфекции, вызванные Varicella zoster (герпес зостер); кандидоз | Воспаление подкожно-жировой клетчатки ≥3 степени тяжести, цистит ≥3 степени тяжести | ||
| Со стороны крови и лимфатической системы | |||
Нейтропения всех степеней тяжести, включая нейтропению с клиническими проявлениями ≥3 степени тяжести*; анемия всех степеней тяжести; лейкопения всех степеней тяжести; тромбоцитопения | Фебрильная нейтропения, все случаи ≥3 степени тяжести; тромбоцитопения ≥3 степени тяжести | ||
| Со стороны иммунной системы | |||
Реакции гиперчувствительности, в т.ч. и тяжелые реакции, такие как генерализованная сыпь/эритема, снижение АД и бронхоспазм | |||
| Нарушения метаболизма и питания | |||
| Анорексия | Обезвоживание всех степеней тяжести; гипергликемия; гипокалиемия | Анорексия ≥3 степени тяжести; гипергликемия ≥3 степени тяжести; гипокалиемия ≥3 степени тяжести | |
| Нарушения психики | |||
Беспокойство, спутанность сознания | |||
| Со стороны нервной системы | |||
| Дисгевзия | Периферическая невропатия: периферическая сенсорная невропатия(парестезия, дизестезия, гипестезия) и периферическая моторная невропатия; головокружение, головная боль, летаргия, ишиас | Периферическая невропатия ≥3 степени тяжести; периферическая сенсорная невропатия ≥3 степени тяжести, летаргия ≥3 степени тяжести, ишиас ≥3 степени тяжести | |
| Со стороны органа зрения | |||
| Конъюнктивит, усиленное слезоотделение | |||
| Со стороны органа слуха и лабиринта | |||
| Звон в ушах, вертиго | |||
| Со стороны сердца* | |||
| Мерцательная аритмия (фибрилляция предсердий), тахикардия (ни одного случая тахикардии ≥3 степени тяжести | Мерцательная аритмия (фибрилляция предсердий) ≥3 степени тяжести | ||
| Со стороны сосудов | |||
| Снижение АД, повышение АД, тромбоз глубоких вен всех степеней тяжести, ортостатическая гипотония, "приливы" крови к коже лица с чувством жара, гиперемия | Снижение АД ≥3 степени тяжести, повышение АД ≥3 степени тяжести, ортостатическая гипотония ≥3 степени тяжести | ||
| Со стороны дыхательной системы, органов грудной клетки и средостения* | |||
| Одышка, кашель | Одышка ≥3 степени тяжести, боль в ротовой полости и глотке, пневмония всех степеней тяжести | ||
| Со стороны ЖКТ | |||
| Диарея, тошнота, рвота, запор, абдоминальные боли | Диарея ≥3 степени тяжести, тошнота ≥3 степени тяжести, рвота ≥3 степени тяжести, запор ≥3 степени тяжести, абдоминальные боли ≥3 степени тяжести, диспепсия, боли в эпигастральной области, геморрой, гастроэзофагеальная рефлюксная болезнь, кровотечение из прямой кишки, сухость слизистой оболочки полости рта, вздутие живота | Кровотечение из прямой кишки ≥3 степени тяжести, сухость слизистой оболочки полости рта ≥3 степени тяжести, вздутие живота ≥3 степени тяжести | Колит, энтероколит, гастрит, нейтропенический энтероколит, желудочно-кишечные кровотечения, перфорация ЖКТ, кишечная непроходимость; кишечная обструкция |
| Со стороны кожи и подкожных тканей | |||
| Алопеция | Сухость кожи, экзема | ||
| Со стороны мышечной, скелетной и соединительной ткани | |||
| Боли в позвоночнике, артралгия | Боли в позвоночнике ≥3 степени тяжести, артралгия ≥3 степени тяжести, боли в конечностях всех степеней тяжести, мышечные спазмы, миалгия, мышечно-скелетные боли в области грудной клетки, боли по боковым поверхностям туловища | Миалгия ≥3 степени тяжести, мышечно-скелетные боли в области грудной клетки ≥3 степени тяжести, боли по боковым поверхностям туловища ≥3 степени тяжести | |
| Со стороны почек и мочевыводящих путей | |||
| Гематурия всех степеней тяжести* | Острая почечная недостаточность всех степеней тяжести; почечная недостаточность всех степеней тяжести; дизурия; почечная колика; гематурия ≥3 степени тяжести*; поллакиурия; гидронефроз; задержка мочи; недержание мочи; обструкция мочеточников всех степеней тяжести | Почечная колика ≥3 степени тяжести, поллакиурия ≥3 степени тяжести, гидронефроз ≥3 степени тяжести, задержка мочи ≥3 степени тяжести | |
| Со стороны репродуктивной системы и молочной железы | |||
| Боли в области малого таза | Боли в области малого таза ≥3 степени тяжести | ||
| Общие нарушения и реакции в месте введения | |||
| Повышенная утомляемость, астения, пирексия | Повышенная утомляемость ≥3 степени тяжести, астения ≥3 степени тяжести, пирексия ≥3 степени тяжести, периферические отеки, воспаление слизистых оболочек, боли всех степеней тяжести, боли в грудной клетке, отеки, озноб, недомогание | Периферические отеки ≥3 степени тяжести, воспаление слизистых оболочек ≥3 степени тяжести, боли в грудной клетке ≥3 степени тяжести, отеки ≥3 степени тяжести | |
| Лабораторные и инструментальные данные | |||
| Снижение массы тела, увеличение активности АЛТ в сыворотке крови | Увеличение сывороточной концентрации билирубина, увеличение активности АСТ в сыворотке крови | ||
* См. описание отдельных нежелательных реакций.
Пострегистрационные данные
Нарушения со стороны почек и мочевыводящих путей
Нечасто: цистит, развившийся вследствие феномена возврата лучевой реакции в ранее облученной области.
Описание отдельных нежелательных реакций
Нейтропения
Нейтропенические осложнения включали нейтропеническую инфекцию, нейтропенический сепсис и септический шок, которые в некоторых случаях приводили к летальному исходу.
Было показано, что применение Г-КСФ уменьшает частоту возникновения и тяжесть нейтропении (см. разделы "Режим дозирования" и "Особые указания").
Нарушения со стороны сердца
При приеме кабазитаксела наблюдались случаи развития сердечной недостаточности (у двух пациентов). Один пациент в группе кабазитаксела умер от сердечной недостаточности. Наблюдались летальные фибрилляции желудочков у 1 пациента и остановка сердца у 2 пациентов. Однако, ни один из этих случаев не был расценен исследователями, как связанный с применением кабазитаксела.
Нарушения со стороны дыхательной системы
Отмечались случаи развития интерстициальной пневмонии/пневмонита, интерстициальной болезни легких, острого респираторного дистресс-синдрома, в т.ч. с летальным исходом.
Гематурия
В 2/3 случаев определялись отягощающие факторы, такие как прогрессирование заболевания, инструментальные вмешательства, сопутствующие инфекции, одновременный прием антикоагулянтов, НПВП, ацетилсалициловой кислоты.
Прочие особые популяции
Пациенты пожилого возраста
Из 371 пациента, получавших лечение кабазитакселом в исследовании по лечению рака предстательной железы, 240 пациентов были в возрасте 65 лет и старше, из них 70 пациентов - старше 75-летнего возраста. Следующие НР встречались на ≥5% чаще у пациентов в возрасте 65 лет и старше по сравнению с пациентами более молодого возраста: повышенная утомляемость, нейтропения с клиническими проявлениями, астения, пирексия, головокружение, инфекции мочевыводящих путей и обезвоживание.
Частота следующих НР ≥3 степени тяжести была выше у пациентов ≥65 летнего возраста по сравнению с пациентами более молодого возраста: нейтропения по результатам лабораторных анализов, нейтропения с клиническими проявлениями и фебрильная нейтропения (см. разделы "Режим дозирования" и "Особые указания").
Из 595 пациентов, получавших лечение кабазитакселом в исследовании EFC11785 по лечению рака предстательной железы, 420 пациентов были в возрасте 65 лет и старше.
Следующие НР встречались на ≥5% чаще сравнению с пациентами более молодого возраста: диарея, повышенная утомляемость, астения, запор, нейтропения с клиническими проявлениями, фебрильная нейтропения, одышка.
Противопоказания к применению
- повышенная чувствительность к кабазитакселу, другим таксанам, полисорбату-80 или к любому из вспомогательных веществ, входящих в состав препарата;
- количество нейтрофилов в периферической крови менее 1500/мм3;
- печеночная недостаточность тяжелой степени (общий билирубин сыворотки крови >3×ВГН);
- одновременное применение с вакциной против желтой лихорадки, а также с другими живыми ослабленными вакцинами (см. раздел "Лекарственное взаимодействие").
Применение при беременности и кормлении грудью
Контрацепция у мужчин и женщин
Вследствие потенциального нежелательного воздействия на мужские гаметы (половые клетки) и потенциального поступления препарата в семенную жидкость, мужчины, получающие лечение кабазитакселом, и их сексуальные партнерши с детородным потенциалом должны использовать надежные методы контрацепции во время лечения и в течение 6 месяцев после введения последней дозы кабазитаксела.
Беременность и лактация
В связи с потенциальным поступлением кабазитаксела в семенную жидкость, мужчины, получающие лечение кабазитакселом, во время лечения должны предотвращать контакт эякулята с тканями другого человека, включая беременных и кормящих грудью женщин.
Фертильность
Пациентам, которым планируется лечение кабазитакселом, рекомендуется провести криоконсервацию спермы перед началом лечения.
Применение при нарушениях функции печени
Препарат Кабазитаксел ЭВЕР Фарма® противопоказан пациентам с печеночной недостаточностью тяжелой степени (общий билирубин сыворотки крови >3×ВГН). У пациентов с печеночной недостаточностью легкой степени тяжести (общий билирубин сыворотки крови >1 до ≤ 1.5×ВГН или ACT сыворотки крови >1.5×ВГН) дозу кабазитаксела следует снизить до 20 мг/м2 площади поверхности тела, при этом требуется соблюдать осторожность, тщательно контролировать состояние пациентов и проводить мониторинг нежелательных реакций.
Применение при нарушениях функции почек
Применение у детей
Применение у пожилых пациентов
Особые указания
Угнетение костномозгового кроветворения
При применении кабазитаксела угнетение костномозгового кроветворения проявляется в виде нейтропении, анемии, тромбоцитопении, или возможно развитие панцитопении (см. ниже дополнительную информацию в подразделах "Нейтропения" и "Анемия").
Нейтропения
В соответствии с рекомендациями Американского общества клинической онкологии и/или современными утвержденными руководствами, для уменьшения риска возникновения или лечения нейтропенических осложнений (фебрильная нейтропения, продолжительная нейтропения или нейтропеническая инфекция) пациенты, получающие лечение кабазитакселом, могут с профилактической целью получать Г-КСФ.
Следует рассмотреть вопрос о первичной профилактике нейтропении с помощью Г-КСФ у пациентов с высокими факторами риска возникновения нейтропении, которые увеличивают вероятность развития осложнений от продолжительной нейтропении (возраст старше 65 лет, низкие показатели общего состояния, предшествующие эпизоды фебрильной нейтропении, интенсивная предшествующая лучевая терапия, пониженное питание или другие серьезные сопутствующие заболевания).
Было показано, что применение Г-КСФ уменьшает частоту возникновения и тяжесть нейтропении.
Нейтропения является наиболее часто встречающейся НР при применении кабазитаксела (см. раздел "Побочное действие"). Требуется еженедельный контроль количества форменных элементов крови (полный общий анализ крови) во время первого цикла (цикл 1) лечения и затем перед каждым следующим циклом лечения для того, чтобы при необходимости уменьшить дозу препарата в следующем цикле (см. раздел "Режим дозирования").
При развитии фебрильной нейтропении или продолжительной нейтропении, несмотря на проводимое соответствующее лечение, лечение кабазитакселом может быть продолжено только после повышения количества нейтрофилов в периферической крови до ≥1500/мм3 (см. раздел "Противопоказания").
Реакции гиперчувствительности
Все пациенты перед введением препарата Кабазитаксел ЭВЕР Фарма® должны получать премедикацию (см. раздел "Режим дозирования").
Пациенты должны тщательно наблюдаться на предмет развития реакций гиперчувствительности, особенно во время первой и второй в/в инфузии кабазитаксела. Реакции гиперчувствительности могут развиться в течение первых нескольких минут после начала в/в инфузии кабазитаксела, поэтому необходимо иметь все необходимое оборудование и лекарственные препараты для оказания неотложной помощи при снижении АД или развитии бронхоспазма. Могут развиваться тяжелые реакции, такие как генерализованная кожная сыпь/эритема, снижение АД и бронхоспазм. При развитии тяжелых реакций гиперчувствительности требуется немедленное прекращение в/в инфузии кабазитаксела и проведение необходимого лечения. Пациентам, имевшим в анамнезе тяжелую реакцию гиперчувствительности, нельзя проводить повторное введение препарата Кабазитаксел ЭВЕР Фарма® (см. раздел "Противопоказания").
Риск развития тошноты, рвоты, диареи и обезвоживания
Если у пациентов после введения препарата Кабазитаксел ЭВЕР Фарма® развивается диарея, им следует проводить лечение обычно применяемыми противодиарейными препаратами. Следует принимать соответствующие меры по восстановлению потерь жидкости, определению и коррекции электролитного состава сыворотки крови, особенно концентрации ионов калия. Диарея чаще может развиваться у пациентов, которым ранее была проведена лучевая терапия абдоминально-тазовой области. Обезвоживание чаще развивается у пациентов 65 лет и старше. При развитии диареи ≥3 степени тяжести может потребоваться отсрочка следующего цикла лечения или уменьшение дозы (см. раздел "Режим дозирования"). При возникновении у пациента тошноты и рвоты возможно применение противорвотных средств.
Риск развития серьезных реакций со стороны ЖКТ
Сообщалось о развитии желудочно-кишечных кровотечений и перфорации, кишечной непроходимости, колита, в т.ч. и с летальным исходом у пациентов, получающих лечение кабазитакселом (см. раздел "Побочное действие"). Следует соблюдать осторожность у пациентов с высоким риском развития желудочно-кишечных осложнений, а именно у пациентов с нейтропенией, пожилого возраста, одновременно принимающих НПВП, получающих антиагрегантную терапию или антикоагулянты, а также у пациентов с ранее проведенной лучевой терапией органов малого таза, заболеваниями ЖКТ, такими как язвенные поражения ЖКТ и желудочно-кишечное кровотечение в анамнезе.
Ранними проявлениями серьезной желудочно-кишечной токсичности могут быть такие симптомы, как абдоминальные боли и болезненность в области живота, лихорадка, упорный запор, диарея с нейтропенией или без нейтропении. Следует регулярно мониторировать состояние пациента на наличие этих симптомов, и в случае их обнаружения немедленно проводить их лечение. Может потребоваться отсрочка или прекращение лечения кабазитакселом.
Периферическая невропатия
У пациентов, получавших лечение кабазитакселом, наблюдались случаи периферической невропатии, включая периферическую сенсорную невропатию (парестезия, дизестезия) и периферическую моторную невропатию. Пациентам, получающим лечение кабазитакселом, следует рекомендовать перед продолжением лечения информировать своего лечащего врача о развившихся у них симптомах невропатии, таких как боль, чувство жжения, покалывание, онемение или повышенная утомляемость. Врач должен оценивать наличие или усиление симптомов невропатии перед каждым циклом лечения. Введение кабазитаксела должно быть отложено до уменьшения симптомов. При персистирующей периферической невропатии ≥2 степени тяжести доза кабазитаксела должна быть снижена с 25 мг/м2 до 20 мг/м2 площади поверхности тела (см. раздел "Режим дозирования").
Риск развития почечной недостаточности
Сообщалось о нарушениях функции почек в сочетании с сепсисом, тяжелым обезвоживанием (вследствие диареи, рвоты) и обструктивной уропатией. Наблюдалось развитие почечной недостаточности, включая случаи с летальным исходом. Следует принимать соответствующие меры для выявления причины развития почечной недостаточности и проводить интенсивную терапию пациентов с развивающейся почечной недостаточностью. Следует мониторировать функцию почек.
При лечении кабазитакселом следует проводить адекватную гидратацию пациента. Пациенту следует рекомендовать немедленно сообщать о любых изменениях в объеме выделяемой за сутки мочи. Следует определять содержание креатинина в сыворотке крови перед лечением, при каждом исследовании общего анализа крови и в случае сообщения пациента об изменении выделения мочи. В случае развития почечной недостаточности ≥3 степени тяжести лечение кабазитакселом должно быть прекращено.
Препарат следует применять с осторожностью у пациентов с терминальной стадией почечной недостаточности (КК< 15 мл/мин) (в связи с их состоянием и ограниченными данными, лечение следует проводить с осторожностью и при тщательном медицинском контроле во время лечения) (см. раздел "Фармакокинетика", "Режим дозирования").
Риск развития цистита вследствие феномена возврата лучевой реакции
У пациентов, получавших ранее лучевую терапию в области таза и схему лечения, содержащую доцетаксел, сообщалось о развитии цистита вследствие феномена возврата лучевой реакции в ранее облученной области. Поэтому при развитии данной НР должны быть приняты соответствующие меры. Может возникнуть необходимость прерывания или отмены терапии кабазитакселом.
Риск развития нарушений ритма сердца
Сообщалось о развитии нарушений ритма сердца, наиболее часто тахикардии и мерцательной аритмии (см. раздел 4.8).
Риск развития нарушений со стороны дыхательной системы
Сообщалось о случаях развития интерстициальной пневмонии/пневмонита, интерстициальной болезни легких, острого респираторного дистресс-синдрома, в том числе с летальным исходом (см. раздел "Побочное действие").
При развитии новых симптомов со стороны дыхательной системы или ухудшении имеющихся симптомов необходимо тщательно наблюдать за состоянием пациентов, оперативно обследовать их и проводить соответствующее лечение. Рекомендуется прервать терапию кабазитакселом до подтверждения диагноза. Раннее применение поддерживающей терапии способствует улучшению состояния пациента. Польза от возобновления терапии кабазитакселом должна быть тщательно оценена.
Пациенты пожилого возраста
Пациенты пожилого возраста (≥65 лет) могут быть более предрасположены к некоторым НР, включая нейтропению или фебрильную нейтропению (см. раздел "Побочное действие").
Пациенты с печеночной недостаточностью
Кабазитаксел интенсивно метаболизируется в печени (см. раздел "Фармакокинетика"). Препарат Кабазитаксел ЭВЕР Фарма® противопоказан у пациентов с печеночной недостаточностью тяжелой степени (общий билирубин >3×ВГН) (см. разделы "Противопоказания" и "Фармакокинетика"). У пациентов с печеночной недостаточностью легкой степени тяжести (общий билирубин сыворотки крови >1 и ≤ 1.5×ВГН или АСТ >1.5×ВГН) и средней степени тяжести (общий билирубин >1 до ≤ 3×ВГН) следует уменьшить дозу кабазитаксела (см. разделы "Режим дозирования" и "Фармакокинетика"). При этом требуется соблюдать осторожность, тщательно контролировать состояние пациентов и проводить мониторинг HP.
Анемия
У пациентов, получающих лечение кабазитакселом, сообщалось о развитии анемии (см.раздел "Побочное действие"). Показатели гемоглобина и гематокрита должны быть проверены до начала терапии кабазитакселом, а также, если у пациентов отмечаются симптомы или признаки анемии или кровопотери. Рекомендуется с осторожностью применять кабазитаксел у пациентов с содержанием гемоглобина в периферической крови < 10 г/дл. Следует проводить соответствующие лечебные мероприятия, направленные на повышение содержания гемоглобина в периферической крови.
Лекарственное взаимодействие
Следует избегать одновременного применения сильных ингибиторов и индукторов изоферментов подсемейства CYP3A с кабазитакселом, т.к. они могут, соответственно, увеличивать или уменьшать концентрацию кабазитаксела в плазме крови (см. разделы "Режим дозирования" и "Лекарственное взаимодействие").
Вспомогательные вещества
Каждый мл концентрата для приготовления раствора для инфузий содержит 197.5 мг этанола.
1 флакон 6 мл содержит 1.185 мг этанола (19.75% м/о). Количество 6 мл в данном лекарственном препарате эквивалентно 30.0 мл пива или 12.5 мл вина.
При применении у лиц с алкоголизмом стоит соблюдать осторожность.
Необходимо учитывать таким группам высокого риска, как пациенты с заболеваниями печени и эпилепсией.
Влияние на способность к управлению транспортными средствами и механизмами
Исходя из профиля безопасности кабазитаксела, препарат может оказывать умеренное влияние на способность управлять транспортными средствами или пользоваться другими механизмами, т.к. может вызывать повышенную утомляемость и головокружение. При появлении подобных НР во время лечения пациентам следует рекомендовать воздержаться от управления транспортными средствами и занятий другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
Ожидаемые симптомы передозировки: усиление дозозависимых НР, таких как симптомы подавления костномозгового кроветворения и нарушения со стороны ЖКТ.
Лечение
Отсутствует известный антидот кабазитаксела. В случае передозировки пациент должен быть помещен в специализированное отделение под тщательное медицинское наблюдение. После того, как станет известно о передозировке, пациенты должны, как можно, скорее, начать получать Г-КСФ. Также следует проводить другое симптоматическое лечение.
Лекарственное взаимодействие
Ингибиторы изоферментов подсемейства CYP3A
Метаболизм кабазитаксела изменяется при одновременном применении веществ, известных как сильные ингибиторы изоферментов подсемейства CYP3A (например, кетоконазол, итраконазол, кларитромицин, атазанавир, индинавир, нефазодон, нелфинавир, ритонавир, саквинавир, телитромицин, вориконазол).
Следует избегать одновременного применения сильных ингибиторов изоферментов подсемейства CYP3A. Если нельзя избежать одновременного применения кабазитаксела и сильного ингибитора изоферментов подсемейства CYP3A следует рассмотреть вопрос о тщательном наблюдении за пациентом и снижении дозы кабазитаксела (см. разделы "Режим дозирования" и "Особые указания").
Следует соблюдать осторожность при одновременном применении кабазитаксела и умеренных ингибиторов изоферментов подсемейства CYP3A.
Индукторы изоферментов подсемейства CYP3A
Метаболизм кабазитаксела изменяется при одновременном применении веществ, известных как сильные индукторы изоферментов подсемейства CYP3A (например, фенитоин, карбамазепин, рифампицин, рифабутин, рифапентин, фенобарбитал).
Следует избегать одновременного применения сильных индукторов изоферментов подсемейства CYP3A, т.к. они могут уменьшить системную экспозицию кабазитаксела (см. разделы "Режим дозирования" и "Особые указания").
Зверобой продырявленный
Пациенты, получающие лечение кабазитакселом, должны воздерживаться от приема препаратов травы зверобоя продырявленного (т.к. он также является индуктором изофермента CYP3A4).
Субстраты транспортного полипептида органических анионов (ОАТР1В1)
Кабазитаксел in vitro также продемонстрировал способность ингибировать ОАТР1В1. Риск взаимодействия с субстратами ОАТР1В1 (например, ингибиторами ГМГ-КоА-редуктазы (статинами), валсартаном, репаглинидом) является возможным во время проведения в/в инфузии (1 ч) и до 20 минут после ее окончания, и в это время возможно увеличение системной экспозиции субстратов ОАТР1В1. Рекомендуется соблюдение следующих временных интервалов при одновременном применении субстратов ОАТР1В1: принимать их за 12 ч до введения кабазитаксела и через, как минимум, 3 ч после введения кабазитаксела.
Преднизолон
Преднизолон/преднизон, принимаемый по 10 мг ежедневно, не оказывает влияния на фармакокинетику кабазитаксела.
Варфарин
Кабазитаксел не ингибирует in vitro главный путь биотрансформации варфарина в 7-гидроксиварфарин, который осуществляется с помощью изофермента CYP2C9. Поэтому не ожидается какого-либо фармакокинетического взаимодействия кабазитаксела и варфарина in vivo.
Вакцинация
Применение живых вакцин или ослабленных живых вакцин у пациентов со сниженным в результате лечения химиотерапевтическими препаратами иммунитетом может приводить к развитию серьезных или летальных инфекций. Следует избегать вакцинации живыми ослабленными вакцинами у пациентов, получающих лечение кабазитакселом. Убитые или инактивированные вакцины применять можно, однако, реакция организма на такие вакцины может быть менее выраженной.
Условия хранения препарата Кабазитаксел ЭВЕР Фарма®
Препарат следует хранить в оригинальной упаковке (пачке картонной) при температуре не выше 30°С. Не замораживать.
Срок годности препарата Кабазитаксел ЭВЕР Фарма®
После первого вскрытия, приготовленный раствор - с микробиологической точки зрения концентрат и инфузионный раствор должны быть использованы сразу.
Условия реализации
Контакты для обращений
ЭВЕР НЕЙРО ФАРМА ООО (Россия)

|
|
107061 Москва, Преображенская пл., д. 8, эт. 7, пом. XLIV, ком. 44 |
X



